
anusorn nakdee/iStock
ファイザー/モデルナが開発したmRNAワクチンやアストラゼネカのウイルスベクターワクチンは、コロナウイルスの遺伝情報をヒトに投与することで、ヒトの細胞からスパイクタンパクを産生させることを考えれば、遺伝子治療そのものである。開発当初から、コロナワクチンに懸念されていたことは、ワクチンの遺伝情報がヒトの遺伝子に組み込まれる可能性である。
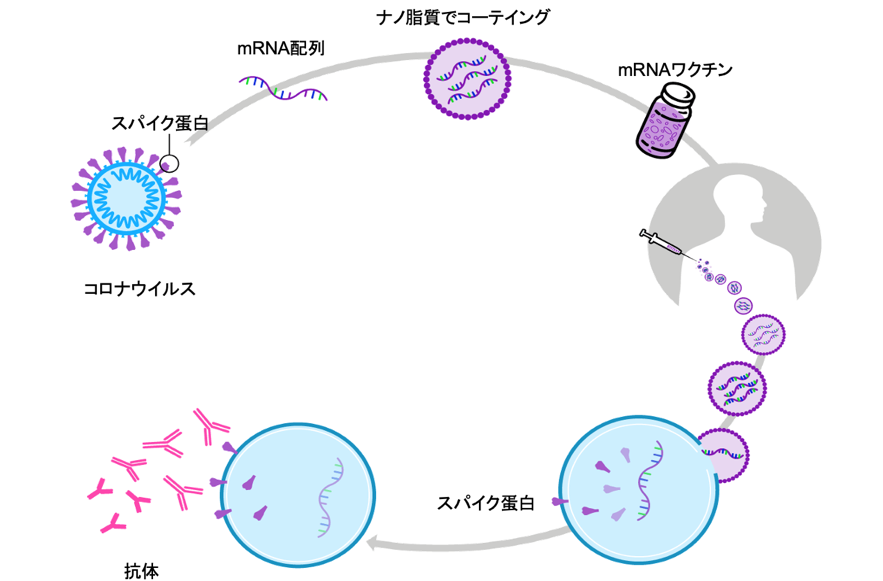
図1 mRNAワクチンの製法
Pfizer Bloomberg Research 改図
遺伝子治療では、ウイルス由来のベクターを用いて遺伝子を細胞の核内DNAに組み込み、目的とするタンパク質を作らせる。遺伝子治療が始まった当初は、アデノウイルスベクターやレトロウイルスベクターが主に用いられていた。
レトロウイルスベクターによる先天性免疫不全症に対する遺伝子治療は、最も早く実用化された遺伝子治療であるが、遺伝子治療を受けた患児から白血病が多発したことから、一旦、先天性免疫不全症に対する遺伝子治療による臨床研究は全世界で中止された。白血病が発生したのは、レトロウイルスベクターで挿入された遺伝子が、がん遺伝子の近くに挿入されてがん遺伝子を活性化したことが原因であった。
その後、安全性を高めたレンチウイルスベクターやアデノ随伴ウイルスベクターが開発されて、遺伝子治療の臨床研究は一気に進んだ。日本でも、2020年に先天性脊髄性筋萎縮症に対する遺伝子治療薬に1億6,700万円の薬価がついて、保険適用となった。
現在、最も実施件数が多い遺伝子治療は、白血病に対するキメラ抗原受容体T細胞療法(CAR-T療法)である。筆者が所属する名古屋大学小児科では、がん化のリスクを減らすために、ウイルスベクターを用いない遺伝子導入法を世界に先駆けて開発することに成功し、現在、小児白血病患者を対象とした臨床研究を行っている。
X連鎖性副腎白質ジストロフィーは、中枢神経系に脱髄が生じる予後不良な疾患であるが、海外ではレンチウイルスベクターによる遺伝子治療の臨床研究が行われている。安全とされているレンチウイルスベクターを用いているが、昨年の発表では、遺伝子治療を受けた67例中3例に骨髄異形成症候群が発症している。以上のように、遺伝子治療では、がん遺伝子の近傍への遺伝子挿入を避けて、がん化のリスクを減らすことが最大の課題である。
遺伝情報は、DNA →(転写)→ mRNA →(翻訳)→ タンパク質の順に伝達されており、この基本原則は、セントラルドグマと名付けられている。厚労省のホームページには、コロナワクチンとしてヒトに投与されるmRNAは、数分から数日で分解され、mRNAからDNAはつくられないので、その情報が長期に残ることや、精子や卵子のDNAに取り込まれることはないと記載されている。
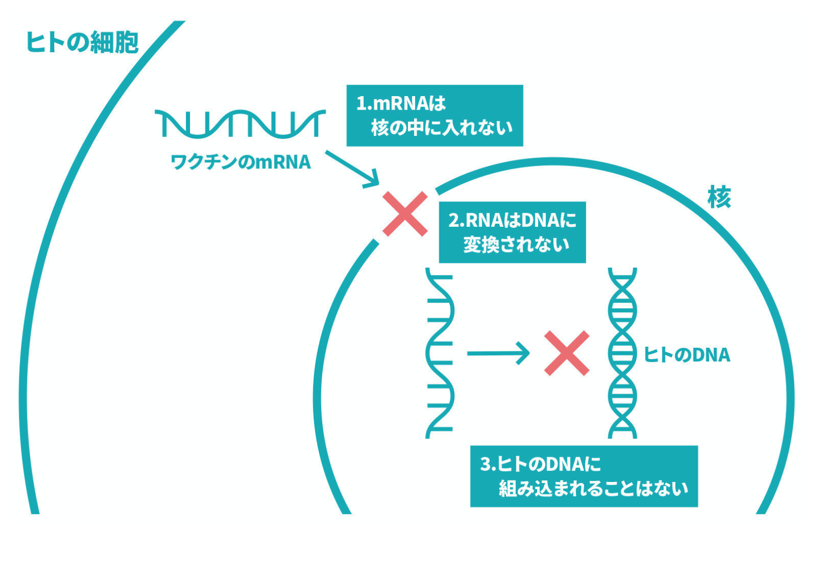
図2 コロナワクチンが安全な理由
厚労省のホームページから
ところが、2022年に、スウエーデンからコロナワクチン由来のmRNA遺伝情報がDNAに逆転写する可能性が報告された。ファイザーmRNAワクチンを添加した培養液中で、ヒトの肝がん由来の細胞株を培養したところ、培養開始から6時間で細胞内においてm RNAがDNAに逆転写することが示されたのだ。なお、この逆転写はヒト内因性逆転写酵素であるLINE-1の働きによることも示された。しかし、この研究では、逆転写されたDNAが核内に侵入して宿主のDNAに組み込まれているかは明らかでない。
本研究結果に対しては、1)逆転写されたDNAが核内に存在することが示されていない、2)もともとLINE-1が過剰発現しているがん細胞株を用いて行われた実験結果であり、正常細胞で同じ結果が得られるのかは明らかではないことを理由に、ワクチン由来の遺伝情報がヒトのDNAに組み込まれる可能性を否定する意見も見られる。
コロナワクチンの遺伝情報がヒト遺伝子に組み込まれるか? この問いに解答を与えるにあたって、新たに重要な情報が発表された。mRNAワクチンの製造工程ではプラズミドが原料となるが、最終工程でプラズミドを除去することが必要で、その混入は基準値以下でなくてはならない。プラズミドは、染色体とは独立した環状2本鎖DNAで、自己複製が可能である。
ファイザー社およびモデルナ社のワクチンサンプルを次世代シークエンサーでRNAシークエンスを行ったところ、欧州医薬品庁(EMA)の基準値を数桁上回るプラズミドの混入が見られたことが報告された。この混入プラズミドは大腸菌を形質転換することも判明している。ことの重要性から、この発表の真偽を至急検討することが必要である。
ワクチンに含まれるmRNAは、哺乳類の細胞でのみ翻訳できるように設計されているので、プラズミドに由来するスパイクタンパクが発現するには、プラズミドがヒトゲノムに組み込まれることを必要とする。ワクチンに混入したプラズミドは、先に説明したLINE-1のような逆転写酵素の働きを必要とせずにヒトゲノムに組み込まれる可能性がある。
このプラズミドがヒトゲノム上のがん遺伝子の近傍に組み込まれると発がんのリスクがあるが、それ以上に問題なのは、持続的にスパイクタンパクが体内で作られる可能性があることである。スパイクタンパクは血管内皮細胞を傷害するなど、ワクチンに見られる種々の副作用の原因であることを考慮すると、上記の報告が事実であるとすれば、その影響ははかり知れない。
遺伝子治療はもともと稀少な遺伝性疾患を対象としており、臨床研究に参加する患者数も数十人程度である。このレベルなら、先天性免疫不全症やX連鎖副腎白質ジストロフィーの例でわかるように、発がんのリスクについてもすぐ気づかれる。
ところが、コロナワクチンについては、すでに億単位のレベルで接種されているので、がん化のリスクを捉えることは容易ではない。ワクチン接種が引き金となって発症したがんと従来のがんとに臨床的な違いがあるわけでもないので、発がんとワクチン接種との因果関係を証明することは困難である。またワクチン接種ががん化を促進する要因としては、ヒトゲノムへの遺伝子の組み込みばかりでなく、免疫監視機構の低下やEBウイルスなどの発がんウイルスの再活性化の可能性も考えられる。
次世代シークエンサーで、がん組織の遺伝子を網羅的に検索し、ワクチン由来の遺伝子配列を検出すれば、ワクチン由来の遺伝子が組み込まれたことによるがん化であることを直接的に証明することができる。
次世代シークエンサーによる遺伝子検査は、研究室レベルではよく用いられる手法であるが、検査費用も高額で保険適用もないことから、臨床現場で実施するのは容易ではない。しかし、この問いに答えを出すには、全国がん登録を詳細に検討して、異常な増加を示すがん種があった場合に、そのがん種を対象に網羅的遺伝子検査を行うこと以外に方法は思いつかない。














