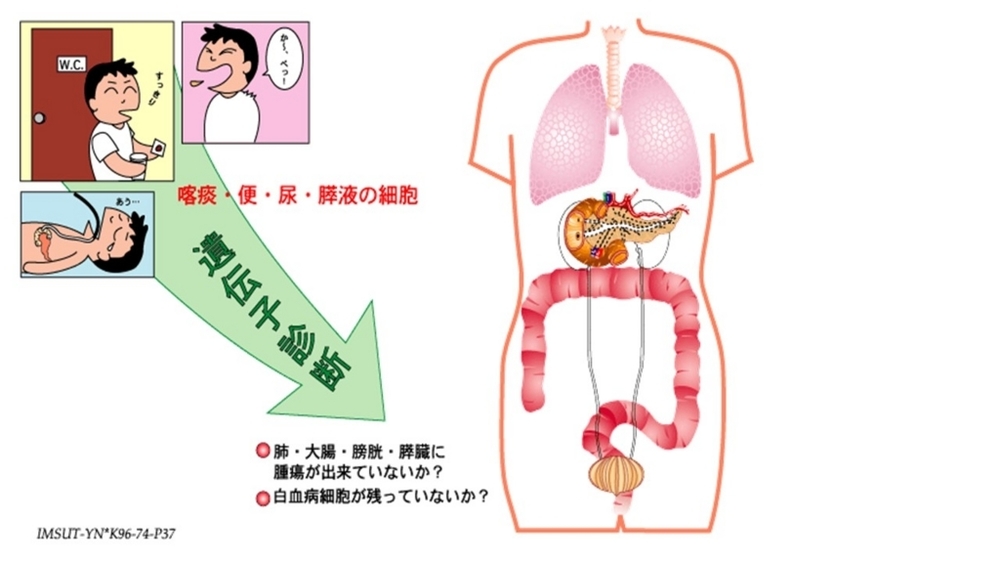
この範疇には、ゲノム情報を利用して、「がんを早期診断すること」、「がんの再発を超早期に診断すること」、「手術後のがん細胞の残存を診断する」、「がん細胞を定量的に計測すること」などが含まれる。
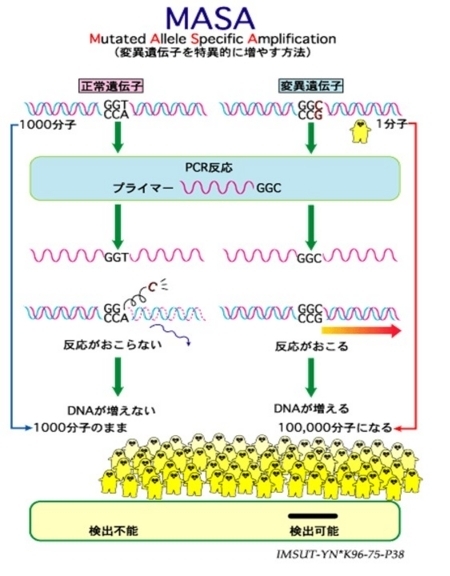
これらを可能にしたのは、DNAシークエンス技術や遺伝子変異を鋭敏に感知する技術だ。特に、正常な1000分子中に1個しかないような異常遺伝子を検出できることになったのは大きい。といっても、特定の遺伝子の変異を高感度に検出する試みは、われわれも含め、20年前から行ってきたことだ。
ひとつの例を紹介したい。
リンパ節中に存在するがん細胞をKRAS遺伝子を利用して検出する方法だ。下にあるのは1996年に作成したスライドである。MASA(Mutated Allele Specific Amplification)と命名した変異遺伝子だけをPCR法(遺伝子増幅法)で増やして、検出することができることを紹介したものだ。正常KRAS遺伝子1000:KRAS変異遺伝子1の割合で存在していても、、PCRの際のプライマーと呼んでいる分子を工夫することで、正常遺伝子を増やさず、変異遺伝子だけをPCR法を利用して増やす(増幅する)ことで、極微量な変異遺伝子の存在を明らかにする方法である。変異遺伝子だけを増やすことによって、PCR前の1000:1の比を1000:100,000に逆転でき、変異遺伝子の存在=非常に少数のがん細胞の検出ができる。ただし、検査は厳格な条件で行わなければならず、習熟した技術者が、手順通りに進めていかないと、疑陽性や偽陰性というエラーが起こる。どんな検査でもそうだが、まともなトレーニングを受けていないものが簡単にできるものではない。
近いうちにすべてが自動化されるだろうが、機械を扱う人が未熟だと、結果が怪しくなる。結果はLancet誌(1995年 林ら)に報告した。がん細胞へのリンパ節転移を遺伝子レベルで検出した結果、組織学的な検査で陰性であっても、遺伝子レベルで陽性であることがあることを示したものだ。
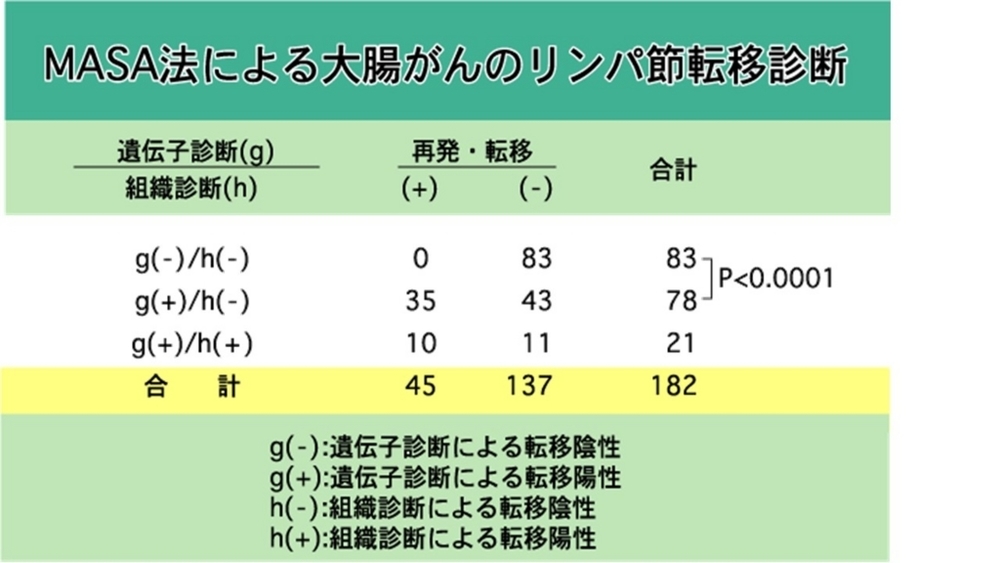
182名の大腸がんケースで調べたところ、組織診断陰性・遺伝子診断陰性の83例は再発がなかったが、組織診断陰性・遺伝子診断陽性78例では、約45%の35例が再発したという結果だった。当時、遺伝子診断陽性例に、強い化学療法をすることによって再発率を下げることができないかどうか、臨床医に相談をした。しかし、残念ながら、現在利用されているような有効な化学療法もなかった時代なので、ここで研究が終わってしまった。時代を先取りしすぎたのかもしれない。「オーダーメイド医療」もそうだが、周りがついて来れないことを言っても、変人扱いされるだけだ。「バイオバンクジャパン」も10-20年後の評価を待ちたい(私はこの世にいないかもしれないが)。その頃にはAMEDもなく、誰も責任を取らないだろうが。
後述する血液を利用したリキッドバイオプシーでも、摘出したがんで見つかったものと同じ異常遺伝子が、術後に血液中に検出された症例は2年以内にほぼ全例が再発していたとジョンスホプキンス大学のグループが報告している。
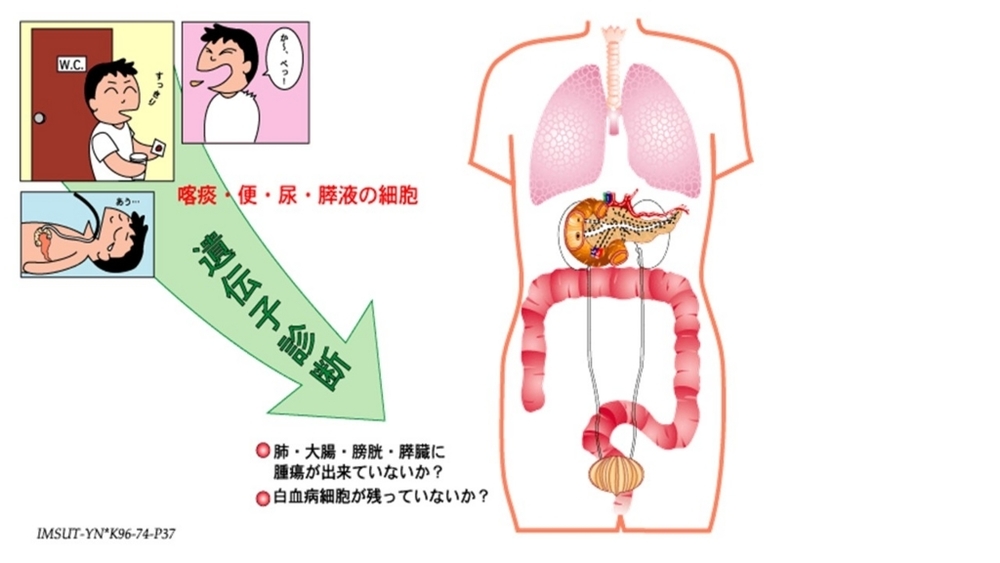
上記も1996年に作成したスライドだ。痰・便・尿・膵液(十二指腸液)を利用したがん診断の可能性を示唆したものだが、血液は含まれていない。まさか、DNAシークエンス技術がこれほど早く進歩すると想像していなかった。技術革新が、できないと思っていたことを可能にしたのだ。
編集部より:この記事は、シカゴ大学医学部内科教授・外科教授、中村祐輔氏のブログ「中村祐輔のシカゴ便り」2018年2月1日の記事を転載させていただきました。オリジナル原稿をお読みになりたい方は、こちらをご覧ください。