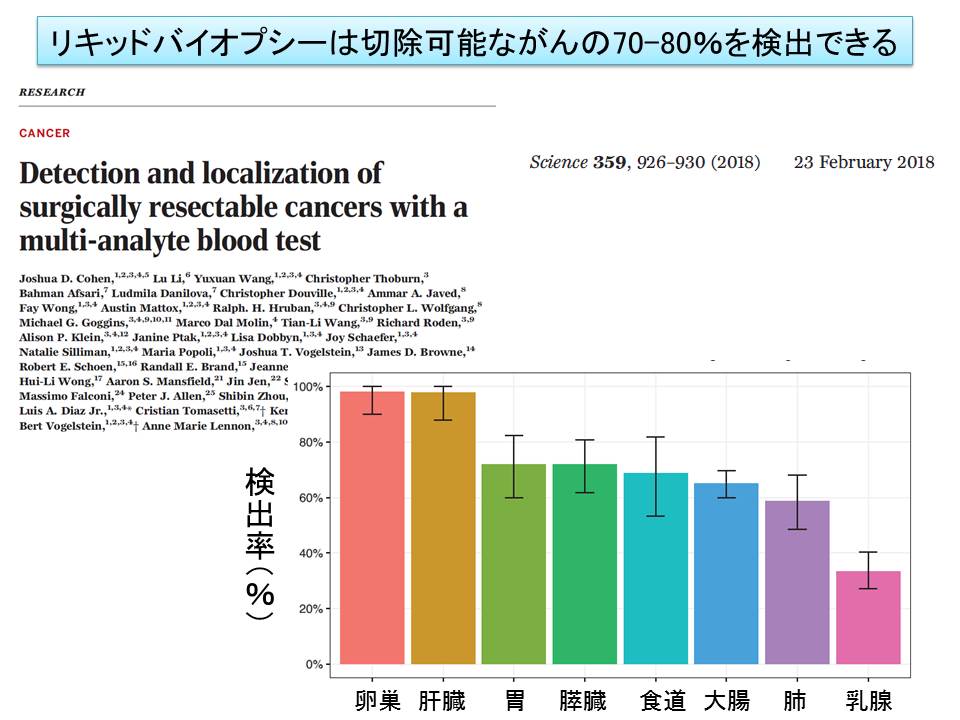
Scienceの2月23日号に「Detection and localization of surgically resectable cancers with a multi-analyte blood test」というタイトルの論文が公表されていた。オンライン版は1ヶ月ほど前に出ていたが、見落としていた。8ヶ所の臓器の外科手術切除可能ながん患者をリキッドバイオプシーで調べたところ、70%程度で異常が検出可能だったという話だ。卵巣がんと肝臓がんでは95%以上、胃がん、膵臓がん、食道がんでは70%前後、大腸がんと肺がんは50%前後、乳がんでは30%程度であった。同じグループからの膵臓がんの以前のデータでは30%程度だったので矛盾はあるし、乳がんの低さが少し気になるが、この程度は見つかるはずだと思う。
検出の感度を上げるために、解析する遺伝子のサイズを非常に短くした(平均33塩基)。できるだけ多くのがん患者さんで遺伝子異常を検出するために、調べる箇所をどんどん増やしていった。60ヶ所程度までは、解析箇所を増やすことによって遺伝子異常の検出率が直線的に増えていったが、それ以上増やしても検出率の向上にはあまり寄与しなかったので、最終的に16遺伝子の61箇所に絞り込んで、さらに検討したものだ。
こらまでに報告されているデータから、検出確率をはじき出したところ、41%(肝臓がん)から91%(膵臓がん)の範囲だった。しかし、肝臓がんでは予測に反して、ほぼ全症例でリキッドバイオプシーでの異常が検出された。実際にがん組織をゲノムを解析したデータからは、この61ヶ所を調べても41%しか検出できないはすが、ほぼ症例でリキッドバイプシー陽性となったのは不思議な気がする。しかし、健常人812名で陽性となったのは、わずか7例であったので、偽陽性率はきわめて低く、肝臓がんのケースも偽陽性のためとは言いがたい。また、健常人の7名は、どこかにがんが潜んでいる可能性があるため、単純に検査結果が間違いとは言えない。たとえ、疑陽性であったとしても、わずか1%であるので、検査としては十分に合格点が与えられる。
ステージ別に見た陽性率も、ステージ1では43%と少し低いが、ステージ2・3では。それぞれ73%、78%であり、がんのスクリーニングとして利用するには十分な値だと思う。リキッドバイプシーの場合、遺伝子異常陽性であっても、臓器の特定が難しいという課題があったのだが、8種類の血清バイオマーカーを組み合わせて臓器を特定するアルゴリズムを作った。これによって、40-80%のケースでは最も可能性の高い臓器が特定でき(臓器によって正解率が異なる。たとえば、APC遺伝子異常であれば、大腸がんの確率が非常に高い)、60-100%のケースでは、少なくとも2番目に可能性の高い臓器にがんが見つかると報告されていた。
そして、重要なのがコストだ。日本からは、ターゲット遺伝子の解析で、50-100万円という価格設定になるといううわさが届いているが、この研究者たちは、この検査が高くとも500ドル以内でできるだろうと解説していた。遺伝子検査を一般に普及して、誰でもがアクセスできるようにするためには、法外な価格設定であってはならない。医薬品も診断も、いいものならば可能な限り高くして企業に利益をもたらすというような発想ではなく、多くの人が利益を得ることができ、そして、医療保険も維持できる方策を考える必要がある。どこまで税負担で切るのかという議論を冷静に行うためにも、企業が近視眼的な利益追求をやめて医療保険制度を破綻することにも目を向けて欲しいものだ。
編集部より:この記事は、シカゴ大学医学部内科教授・外科教授、中村祐輔氏のブログ「中村祐輔のシカゴ便り」2018年2月28日の記事を転載させていただきました。オリジナル原稿をお読みになりたい方は、こちらをご覧ください。













