
tommy/iStock
SNS上では、コロナワクチン接種後にがんの進行が加速したとか、知り合いが進行がんを発症し短期間で死亡したといった情報が溢れており、ターボがんなる造語も拡散している。
コロナワクチンの接種によって、がん死亡が増加したか否かは、国民にとって関心の的である。しかし、まだワクチン接種が始まって2年足らずであり、ワクチン接種によってがんによる死亡が増えたかを見極めるには、中・長期の観察が必要である。
コロナワクチンは、一種の遺伝子治療である。過去を振り返れば、がん、とりわけ白血病の発症は、遺伝子治療における最大の懸念事項であり、コロナワクチンが遺伝子治療であることを考慮すれば、この問題に触れないわけにはいかない。全国を対象にした人口動態統計やがん登録を用いて、がん死亡の推移を注視する必要がある。
つい最近、6月2日に、2022年の人口動態統計が公表された。この統計には、年次の総死亡数のほか、個々の死因における死亡数が含まれている。がんについても、総数のほか、胃がん、肺がん、白血病といった個々のがんの死亡数も記載されている。ワクチン接種前後を比較することで、ワクチン接種が、個々のがんによる死亡数の増減に影響を与えたかを知ることが可能である。
図1は、2020年、2021年、2022年のがんによる死亡数と、2016年から2019年のがん死亡の平均との差を算出して、平均に対する割合をグラフ化したものである。
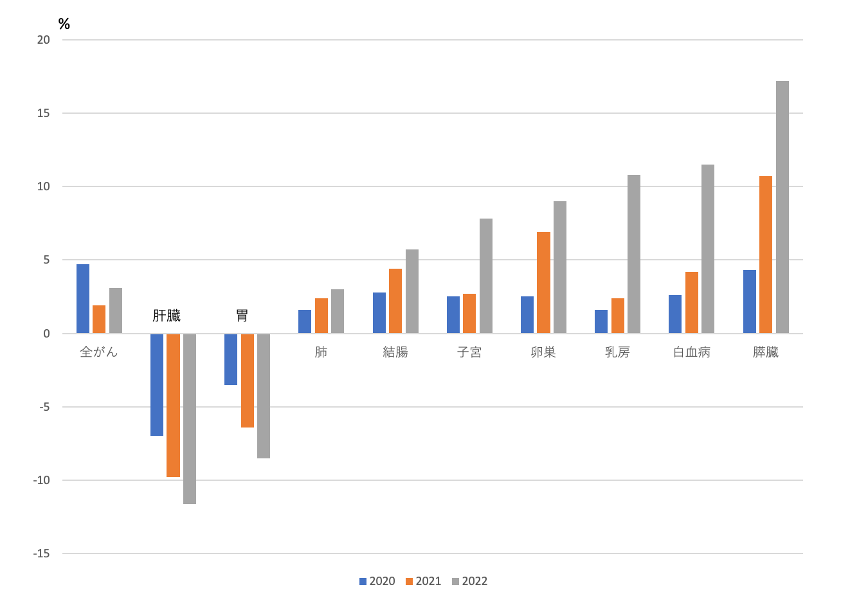
図1 コロナ流行前と流行後におけるがんによる死亡数の変化
4年間のがんによる年間総死亡数の平均は、374,083であるが、2020年、2021年、2022年の死亡数は、それぞれ、391,545、381,505、385,787であった。平均との差は、17,462、7,422、11,704であり、その差の平均に対する割合は、4.7%、1.9%、3.1%であった。
わが国でコロナの流行が始まったのは2020年以降であり、コロナワクチンの接種は2021年からである。ワクチン接種のがん死亡に与える影響は、2020年と2021年、2022年を比較することで知ることができるが、ワクチン接種の普及と発症から死亡までの期間を考慮すると2022年の死亡数がより重要である。
ワクチン接種前の2020年と比較して、接種後の2021年、2022年の全がんの死亡数は減少しており、コロナワクチンの接種ががん死亡を増加させたという結果は得られていない。とりわけ2020年、2021年、2022年の肝がんの減少率は、-7.0%、-9.8%、-11.8%、胃がんの減少率は-3.5%、-6.4%、-8.5%と著しい。
しかし、個々のがんのなかには、子宮がん、卵巣がん、乳がん、白血病、膵臓がんのようにワクチンの接種開始後、とりわけ、2022年に死亡数が増加したがんもある。
図2は、ワクチン接種後に死亡数が増加した5種のがんについて、過去10年間の死亡数の推移を示す。膵がん、卵巣がんは一貫して死亡数は増加しているが、乳がん、子宮がん、白血病は、2021年と比較して2022年に急峻な増加が見られる。
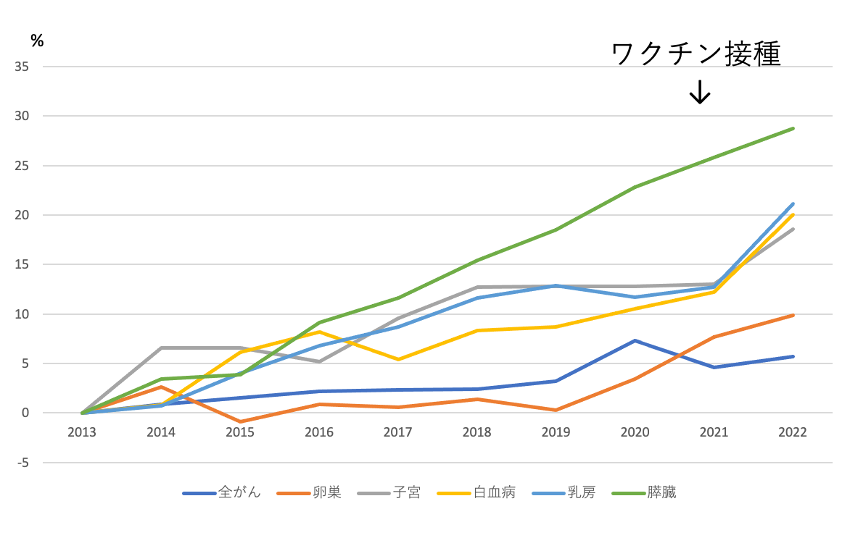
図2 過去10年間におけるがんによる死亡数の推移
2つのグラフからは、子宮がん、乳がん、白血病の死亡数はコロナワクチン接種開始後に増加したように見えるが、コロナワクチンによって、子宮がん、乳がん、白血病死が増加した理由を説明できるだろうか?
コロナワクチンの接種によって体内に産生されたスパイクタンパクは、細胞表面にあるACE2受容体と結合するが、最近の研究によると、スパイクタンパクはエストロゲン受容体とも結合し、転写を活性化することが判明した。
乳がん細胞株の培養液に、エストロゲンの一種であるエストラジオールを添加すると乳がん細胞は増殖するが、選択的エストロゲン受容体拮抗薬であるラロキシフェンを添加すると増殖は阻害される。スパイクタンパクも同様に、培養液に添加すると、乳がんの細胞株は増殖し、ラロキシフェンの添加により増殖は阻害される。
エストロゲン受容体は、乳がんのほか、子宮がんや卵巣がんにも発現している。このことから、ワクチンを接種して体内にスパイクタンパクが産生されると、乳がんや子宮がん、卵巣がんの進行を早める危険性がある。昨年末に発表された基礎的論文で指摘された懸念が、実際の臨床データで裏付けられたことになる(Sci. Adv: 8, 30 Nov 2022)
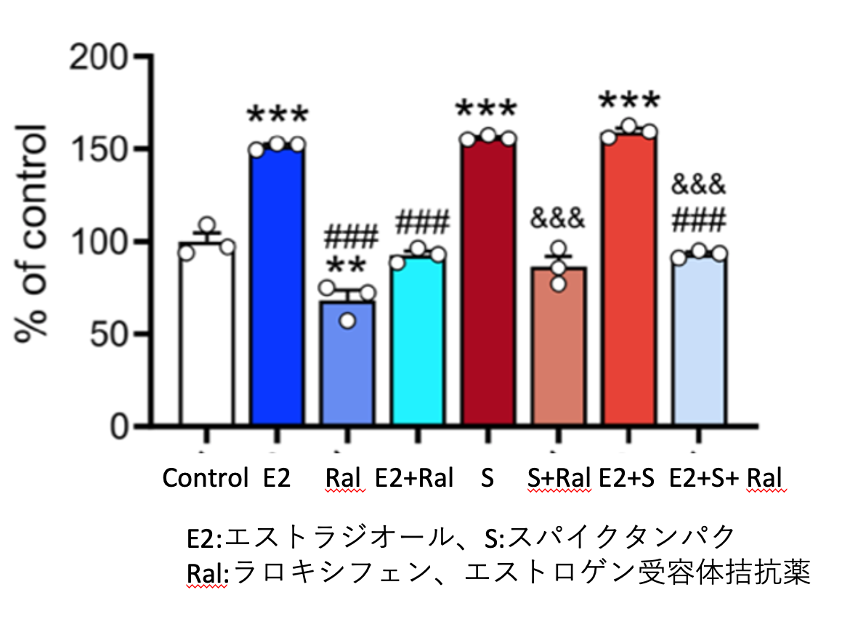
図3 スパイクタンパクは乳がん細胞株の増殖を促進する!
表には、先天性免疫不全症などの遺伝性疾患に対する遺伝子治療における白血病発生のリスクを示す。
遺伝子治療の発展には、がん化のリスクを軽減し、安全な遺伝子導入技術を開発することが最も重要である。遺伝子治療の開発初期には、遺伝子導入にレトロウイルスベクターが用いられたが、30〜100%と極めて高頻度に白血病を発症した。導入遺伝子がヒトの遺伝子に組み込まれる際に、挿入部位の近傍にあるがん遺伝子を活性化したことががん化の原因と考えられる。
より安全とされるレンチウイルスベクターによる遺伝子治療を受けた67人の副腎皮質ジストロフィーの患者からも3人に骨髄異形成症候群が発症した。
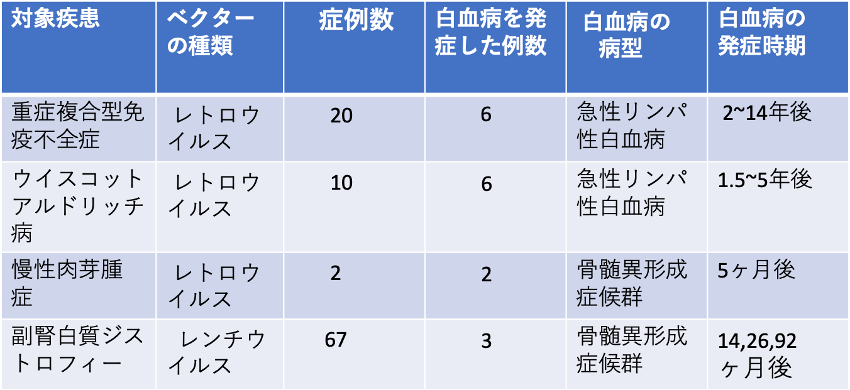
表 遺伝子治療にともなう白血病発生のリスク
現在コロナワクチンについて、研究者の間で最も関心を集めているのは、コロナワクチンへのプラズミドDNAの混入の疑いである。mRNAとは異なり、DNAはヒトの遺伝子に組み込まれる可能性がある。mRNAワクチンの製造工程ではプラズミドが原料となるが、最終工程でプラズミドを除去することが必要で、その混入は基準値以下でなくてはならない。
ファイザー社およびモデルナ社のワクチンサンプルを次世代シークエンサーで遺伝子解析を行ったところ、欧州医薬品庁(EMA)の基準値を上回るプラズミドの混入が見られた。とりわけ、ファイザーのmRNAワクチンから、DNA腫瘍ウイルスのプロモーター配列が見つかったが、この配列はヒトゲノムに取り込まれると近傍遺伝子の転写活性を高める働きがある。
もし、がん遺伝子の上流に組み込まれると、がん遺伝子を活性化して発がんリスクが高まる。これまで、遺伝子治療後の発がんは血液細胞に限られており、今回、エストロゲン受容体が関係する婦人科系腫瘍と並んで、白血病の増加が見られたのは気になるところである。遺伝子治療後の白血病の発症時期が、0.5〜14年後の広範囲であることから、今後も長期間の観察が必要である。
今回の検討では、思いの外ワクチン接種後の早期から、一部のがんによる死亡数の増加が観察された。乳がん、子宮がんの増加は、今回の結果が得られる以前から懸念されていたことである。とりわけ、エストロゲン受容体の発現が見られる婦人科系腫瘍の既往歴がある場合には、スパイクタンパクが血液中に持続的に検出される場合には再発リスクが高まる可能性がある。エストロゲン受容体拮抗薬が再発リスクを軽減できるかを検討することも考慮する必要がある。














